iPS細胞とは?
What are iPSCs?
iPS細胞とは?
What are iPSCs?
iPS細胞とは?
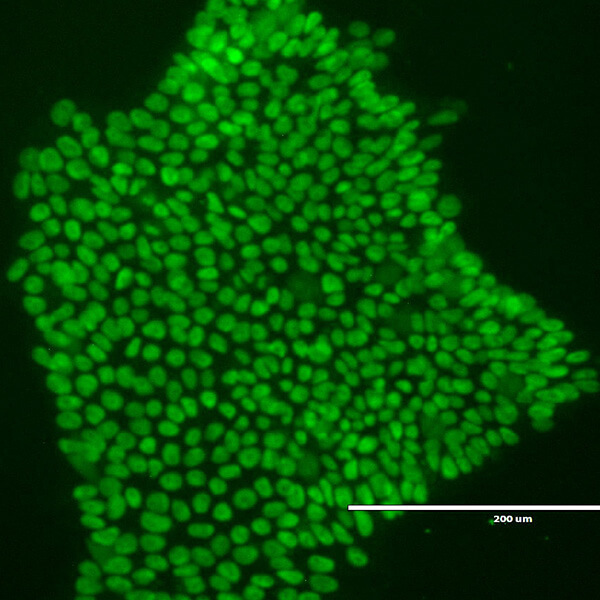
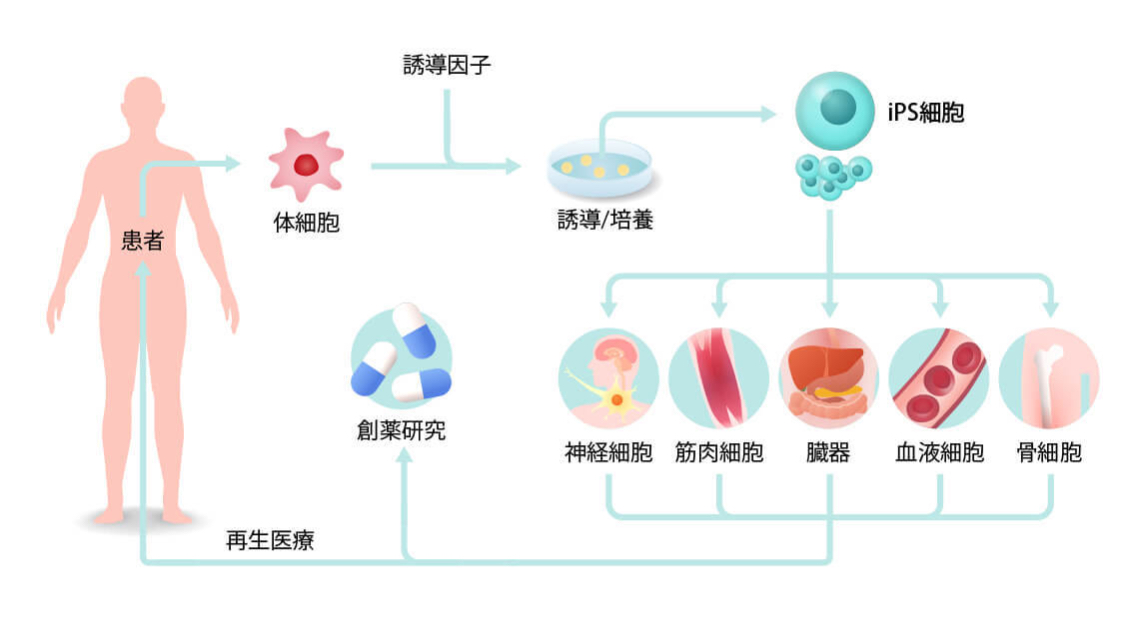
iPS細胞とは、人工多能性幹細胞(induced pluripotent stem cell)の略称で、英語名称の頭文字をとってiPS細胞と呼ばれています。京都大学iPS細胞研究所の山中伸弥教授が開発し、その成果を基に2012年にノーベル生理学·医学賞を受賞されています。iPS細胞は、人間の皮膚や血液などの細胞に特殊な因子を導入し培養することで作製されます。
iPS細胞の主な特徴
以下の3つの特徴を活かすことで、ヒトの神経、心筋、T細胞等の様々な種類の必要な細胞を必要な量だけ手に入れることができます。iPS細胞の状態で十分な量に増やし、その後、必要な種類の細胞に変換することにより再生医療や創薬に活用することが出来ます。さらに、自分自身の細胞を元に作製したiPS細胞を用いることにより、免疫反応のリスクの無い再生医療を受けることが可能となります。
1.理論的に体中のあらゆる種類の細胞から作製できること
血液、皮膚、髪の毛の細胞など様々な種類の細胞に特殊な因子を導入し、培養することで作製します。
1.理論的に体中のあらゆる種類の
細胞から作製できること
血液、皮膚、髪の毛の細胞など様々な種類の細胞に特殊な因子を導入し、培養することで作製します。
2. 様々な組織や臓器の細胞に変化することが出来ること
iPS細胞の大きな特徴、それは「多能性」を備えていることです。多能性とは神経や筋肉など様々な種類の細胞になることができることを意味します。
2. 様々な組織や臓器の細胞に変化する
ことが出来ること
iPS細胞の大きな特徴、それは「多能性」を備えていることです。多能性とは神経や筋肉など様々な種類の細胞になることができることを意味します。
3. ほぼ無限に増殖する能力を持っていること
iPS細胞は、細胞分裂することで自分自身の分身をどんどん増やすことが出来るので、必要な量を増やして得ることができます。
3. ほぼ無限に増殖する能力を持って
いること
iPS細胞は、細胞分裂することで自分自身の細胞を増やすことが出来るので、必要な量を増やして得ることができます。
iPS細胞技術の応用例
iPS細胞技術の応用例は大きく分けると2つの方向性があり、一つはiPS細胞から神経や筋肉などの細胞を作製して移植する細胞移植医療、いわゆる再生医療です。もう一つは、患者さんの細胞から作ったiPS細胞を用いて創薬スクリーニングを行ったり、病態を再現して疾患のメカニズムを探る研究に利用することです。
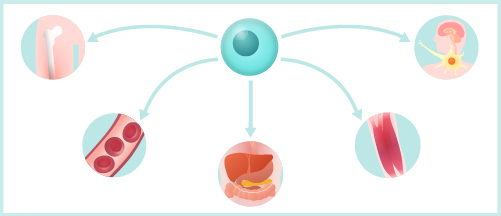
1. 移植再生医療への応用
再生医療とは、怪我や病気で体が失ってしまった機能を回復させるための治療です。iPS細胞は理論上体のどの細胞からでも作ることが出来、体を構成する様々な細胞となることが可能です。また、ほぼ無限に増やすことができるため理想的な細胞移植治療のソースと考えられます。iPS細胞を使った再生医療の例として、交通事故などで脊髄を損傷し麻痺した手足の機能をiPS細胞から作った神経のもとになる細胞を患者さんに移植して回復させる治療などが挙げられます。また、自分自身の細胞からiPS細胞を作れば、理論上免疫拒絶反応のリスクがほぼない細胞移植医療が可能となります。

2.薬の開発、病気の原因を調べる
患者さんの血液などから作ったiPS細胞から作製した神経や心筋などの細胞は病気の情報をそのまま抱えています。その病気の特徴を抱えた細胞を培養皿上で培養して、病態を観察することができると考えられています。つまり、培養皿内で病態を再現し、病気の性質やメカニズムを観察することができます。また、その細胞に様々な医薬品の候補となる化合物等を作用させることにより、試験管の中で薬の効果や毒性を確認することが可能になります。
また、注目を集めるがんの治療研究の一つとしてCAR-T細胞療法の研究が進められています。これはがん患者自身のT細胞と呼ばれる免疫細胞を取り出して改変・増殖させ、体内に戻したうえでがん細胞を攻撃するように仕向ける治療法です。疾患を再現するツールとしてのiPS細胞という観点では、病気のメカニズムの研究や新薬の開発にiPS細胞を利用することは、非常に有益な点が2つあります。一つは、人間の細胞を使って調べることが可能になること。もう一つはiPS細胞は無限に増殖することが出来るので、研究に必要な細胞をいくらでも得ることが出来るということです。研究者が病気の原因について調べ新薬を開発する際、患者さんから研究用のサンプルとして細胞等を採取することがあります。一回の採取で得られる細胞数は限られていますので、当然実行できる実験の数にも制限があります。研究の現場では、数えきれないほどのトライアンドエラーを繰り返してようやく原因を突き止め、効果のある薬が見つかるのです。つまり、研究には相当な量の細胞が必要となります。しかし、サンプルの採取は少なからず患者さんの負担になる為、何度も行うことは叶いません。実験動物を使う手法も一般的ではありますが、動物は人間とは異なる為動物実験で効果があった医薬品候補物質が人間では全く効果が見られなかったとう例も少なくありません。患者さん由来のiPS細胞から作った細胞と動物実験をうまく組み合わせて研究することで、短期間で効率的に新薬を開発することが出来る上、より正確に薬の効能を評価することが可能になります。さらに、薬は遺伝的背景や環境要因の違いなどにより個々人ごとに効き目や副作用が異なることがあるので、患者さん自身の細胞から作ったiPS細胞を利用することにより、個々人に最適な薬を見つけ出す個別化医療も夢ではなくなります。とくに患者数の少ない難病の治療薬は開発コストの大幅な上昇が懸念されていますが、iPS細胞の活用によるコスト低減効果は非常に大きいと考えます。
2007年に山中伸弥教授がヒトiPS細胞作製に成功したことを発表されて以来、国内外で臨床応用に向けて様々な研究が行われています。
2017年にはiPS細胞由来の網膜色素上皮細胞を移植する臨床研究が始まり、2018年にはパーキンソン病の患者さんにiPS細胞由来のドパミン神経細胞を移植する治験が開始されました。また、同じ年に重症虚血性心筋症の患者さんにiPS細胞由来の心筋細胞シートを移植する臨床研究も始まり、2019年には脊髄損傷の患者さんにiPS細胞由来の神経前駆細胞を移植する臨床研究計画が厚生労働省によって承認されています。それ以外にも、糖尿病、角膜疾患、脳梗塞、さらには肝臓や腎臓の疾患への応用も研究が進められています。
また、注目を集めるがんの治療研究の一つとしてCAR-T細胞療法の研究が進められています。これはがん患者自身のT細胞と呼ばれる免疫細胞を取り出して改変・増殖させ、体内に戻したうえでがん細胞を攻撃するように仕向ける治療法です。疾患を再現するツールとしてのiPS細胞という観点では、病気のメカニズムの研究や新薬の開発にiPS細胞を利用することは、非常に有益な点が2つあります。一つは、人間の細胞を使って調べることが可能になること。もう一つはiPS細胞は無限に増殖することが出来るので、研究に必要な細胞をいくらでも得ることが出来るということです。研究者が病気の原因について調べ新薬を開発する際、患者さんから研究用のサンプルとして細胞等を採取することがあります。一回の採取で得られる細胞数は限られていますので、当然実行できる実験の数にも制限があります。研究の現場では、数えきれないほどのトライアンドエラーを繰り返してようやく原因を突き止め、効果のある薬が見つかるのです。つまり、研究には相当な量の細胞が必要となります。しかし、サンプルの採取は少なからず患者さんの負担になる為、何度も行うことは叶いません。実験動物を使う手法も一般的ではありますが、動物は人間とは異なる為動物実験で効果があった医薬品候補物質が人間では全く効果が見られなかったとう例も少なくありません。患者さん由来のiPS細胞から作った細胞と動物実験をうまく組み合わせて研究することで、短期間で効率的に新薬を開発することが出来る上、より正確に薬の効能を評価することが可能になります。さらに、薬は遺伝的背景や環境要因の違いなどにより個々人ごとに効き目や副作用が異なることがあるので、患者さん自身の細胞から作ったiPS細胞を利用することにより、個々人に最適な薬を見つけ出す個別化医療も夢ではなくなります。とくに患者数の少ない難病の治療薬は開発コストの大幅な上昇が懸念されていますが、iPS細胞の活用によるコスト低減効果は非常に大きいと考えます。
iPS細胞の発展
1958
カエルの体細胞の初期化に成功
(Sir John Bertrand Gurdon)
1998
ヒトES細胞の樹立
2006
マウスiPS細胞の樹立
2007
ヒトiPS細胞の樹立
2012
Sir John Bertrand Gurdon / 山中伸弥博士
ノーベル医学生理学賞受賞
再生医療分野
2009
ヒト幹細胞として初の
臨床実験許可
(ES細胞・脊椎損傷)
2013
7月 加齢黄斑変性 臨床試験承認(iPS細胞世界初)
2018
9月 血小板 臨床試験承認
11月パーキンソン病 移植実績一例目
2019
2月 脊椎損傷 臨床試験承認
4月 加齢性黄斑変性 5例の移植1年後経過観察終了
8月 角膜 移植実績一例目
12月 NK Cell細胞療法 移植実績一例目
2020
1月 軟骨移植治療 臨床試験承認
1月 心筋 移植実績一例目
創薬分野
2016
1月 脊椎性筋委縮症 治験開始
2017
8月 進行性骨化性繊維異形成症 治験開始
2016
4月 ペンドレッド症候群 治験開始
12月 以降 筋萎縮性硬化症 治験開始(合計3件)
1998
ヒトES細胞の樹立
マウスiPS細胞の樹立
2006
2007
ヒトiPS細胞の樹立
2009
ヒト幹細胞として初の臨床実験許可
(ES細胞・脊椎損傷)
2012
Sir John Bertrand Gurdon /
山中伸弥博士
ノーベル医学生理学賞受賞
2018
2013
9月 血小板臨床試験承認
11月 パーキンソン病移植実績一例目
2016
1月 脊椎性筋委縮症治験開始
2017
8月 進行性骨化性繊維異形成症
治験開始
2019
2月 脊椎損傷臨床試験承認
4月 加齢性黄斑変性5例の移植1年後経過観察終了
8月 角膜 移植実績一例目
12月 NK Cell細胞療法移植実績一例目
2020
1月 軟骨移植治療臨床試験承認
1月 心筋移植実績一例目
2018
4月 ペンドレッド症候群治験開始
12月- 筋萎縮性硬化症治験開始
(合計3件)
担当者よりご連絡させていただきます。